Il gas di anidride solforosa emana un aroma acre e pungente che ricorda un fiammifero bruciato.
Non è possibile fare vino senza la SO2 perché tutti i lieviti durante la fermentazione producono solfiti come intermedio metabolico nella riduzione dei solfati.
I ceppi di lieviti si possono classificare in basso produttori di SO2 (e.g. Saccharomyces cerevisiae var. ellipsoideus) ed alto produttori (e.g. Saccharomyces bayanus Sacardo).
Il consumatore è sempre più sensibile ai temi della sostenibilità e delle produzioni green; trend registrato da una forte crescita nel consumo di prodotti ”Bio”.
Sono attualmente oggetto di studio numerose alternative all’impiego dell’anidride solforosa nei mosti e nei vini; tuttavia rimane il conservante più rappresentativo per il settore enologico.
L’anidride solforosa ha diverse proprietà di interesse enologico:
- è un antimicrobico: aiuta a prevenire lo sviluppo di microbi batterici ed inibisce i lieviti non selezionati
- è un antiossidasico per la sua capacità di inibire l’imbrunimento enzimatico
- è un antiossidante per la sua capacità di ridurre le ossidazioni di natura chimica delle sostanze fenoliche
- aiuta a prevenire aromi e colore durante la conservazione per preservare le qualità e le caratteristiche del vino.
- favorisce la torbidità favorendo la separazione delle sostanze fecciose in sospensione.
Viene utilizzata durante tutte le fasi di produzione, dalla raccolta all’affinamento.
E’ importante calcolare la giusta dose al momento giusto, per svolgere il compito desiderato senza eccessi e senza compromettere la qualità del vino
L’anidride solforosa è presente nel vino sotto diverse forme
SO2 LIBERA
L’anidride solforosa libera è presente come Molecolare – Acido Solforoso H2SO3 (frazione non dissociata), Ione Bisolfito HSO3 – (frazione semi-dissociata) e come Ione Solfito SO3–(frazione totalmente dissociata).
La formula che lega la SO2 è:

Il potere della SO2 Libera è:
- Antiossidante e Antiossidasico nella forma Ione Bisolfito e Molecolare
- Antisettica nella sua forma molecolare
Come si può vedere dal grafico sottostante, al valore di pH del vino, la forma Ione Solfito SO3 è in piccolissime quantità
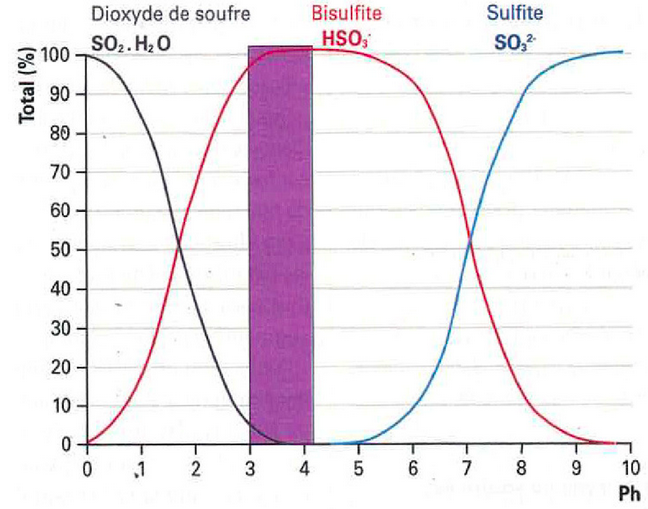
Dalla prima formula si può notare come l’equilibrio tra lo Ione Bisolfito e la SO2 molecolare dipenda dallo ione H+, quindi dal pH, oltre ovviamente dalla temperatura, e dalla concentrazione alcolica.
Lo Ione Bisolfito è il più presente legato ad acetaldeide, glucosio, chinoni, antocianine e chetoacidi.
Il suo equilibrio dipende dal pH, dalla Temperatura e dalla concentrazione Alcolica
Il suo valore diminuisce con il passare del tempo quindi è necessario determinarlo spesso
L’equilibrio tra la SO2 Combinata Labile e la SO2 Libera dipende unicamente dalla temperatura, infatti un innalzamento della temperatura può trasformare SO2 Combinata in SO2 Libera.
SO2 MOLECOLARE
Rappresenta la forma non dissociata (H2SO3 Acido Solforoso) e manifesta odore e gusto caratteristici.
E’ estremamente importante conoscere la sua concentrazione in quanto è l’unica forma a svolgere un ruolo antisettico di stabilizzazione microbiologica del vino, grazie alla sua attività batterica e fungicida.
Piccole variazioni di SO2 Molecolare provocano effetti significativi sull’ambiente del mosto/vino
Il valore pKa (forza dell’Acido) è influenzato da diversi parametri che sono la temperatura, il grado alcolico e la forza ionica ovvero la concentrazione dei sali (ione e catione del vino .. Ioni Solfati, Ione Carbonato, Catione K + Potassio, Catione Ca ++, Catione Magnesio ++, Catione Sodio Ca ++)
La temperatura che favorisce l’assunzione da parte delle cellule della SO2 molecolare ha la sua massima influenza a 50 °C.

Come si determina la SO2 Molecolare?
Per la determinazione della SO2 Molecolare è necessario conoscere con esattezza la misura della SO2 Libera
Tabella per rapportare il valore a 20°
Conoscendo il pH e il grado Alcolico è possibile determinare la concentrazione di SO2 Molecolare dalla tabella Michelet. Si può notare che la concentrazione aumenta con il diminuire del pH e con l’aumentare dell’Alcool.
Tabella per determinare il valore della SO2 Molecolare alla temperatura di stoccaggio

SO2 COMBINATA
L’anidride solforosa combinata è presente legata in modo più o meno stabile con composti come acetaldeide, zuccheri, acidi chetonici, acidi uronici, prodotti d’ossidazione degli zuccheri ed antociani.
In funzione della stabilità del legame, viene effettuata un’ulteriore distinzione tra:
Combinata Labile cioè legami di debole entità che possono dissociarsi per riscaldamento, originare SO2 libera.
Combinata Stabile cioè legata in modo forte con l’acetaldeide.

Questo legame si può rompere durante l’ossidazione con la liberazione dell’acetaldeide
SO2 TOTALE
La SO2 Totale è data la somma di tutte le forme della SO2 presenti nel vino:
H2SO3 Molecolare +
HSO3- Ione Bisolfito +
SO3– Ione Solfito +
Combinata Labile +
Combinata Stabile =
SO2 Totale
SO2 DETERMINAZIONE ANALITICA
Esistono vari sistemi di analisi per determinazione della SO2, nei vini mosti e suoi derivati, tutti regolamentati dall’ O.I.V INTERNATIONAL ORGANISATION OF VINE AND WINE (Organizzazione Internazionale della
Vigna e del Vino)
METODO RIPPER – SCHMITT
OIV-MA-AS323-04B
La determinazione dell’anidride solforosa con il metodo Ripper – Schrnitt si basa sull’ossidazione dei solfiti con lo iodio in presenza dell’indicatore «salda d’amido».
OSSIDAZIONE: SO2→ SO3+ 2e –
(nell’ossidazione perde 2 elettroni)
RIDUZIONE: I2 + 2e-→ 2 I –
(la molecola I2 accetta 2 elettroni per ridursi)
Reazione redox complessiva:
SO2 + I2 + H2O ———> SO3 + 2 HI
SO3 + H2O ——-> H2SO4
Quando tutta l’SO2 è stata ossidata a SO3, lo I2 non trova SO2 da ossidare e si colora di blu-violetto in presenza di salda d’amido. Per determinare l’SO2 totale, è necessario liberare la SO2 combinata operando un’idrolisi alcalina in modo che diventi ossidabile direttamente dallo I2 in ambiente acido.
L’ambiente deve essere molto acido (pH < 1) altrimenti lo I2 potrebbe ossidare anche i polifenoli.
Se il campione ha valori elevati di rame, si complessa con pochi mg di EDTA, escludendolo dalla reazione.

L’aggiunta dell’Acido Solforico libera gran parte della SO2 combinata agli Antociani
Nei vini Rossi per identificare il punto di fine titolazione normalmente si utilizza una lampada a luce gialla polarizzata.

Lampada FM10
Se è stato aggiunto Acido Ascorbico, il risultato è influenzato dalla sua concentrazione perché è ossidabile dallo Iodio
Per la sua determinazione procedere nel seguente modo:
° prelevare 50ml di campione
° aggiungere 5ml di Aldeide propionica o Aldeide Acetica in modo da inibire la SO2.
° eseguire l’analisi della SO2 Libera del campione
° il valore ottenuto rappresenta la concentrazione di Acido Ascorbico.
 Per ridurre i tempi, eliminare l’errore umano e automatizzare il processo d’analisi vengono utilizzati i Titolatori automatici.
Per ridurre i tempi, eliminare l’errore umano e automatizzare il processo d’analisi vengono utilizzati i Titolatori automatici.
Trovate maggiori informazioni alla pagina:
https://www.exactaoptech.com/enologia/titolatorihach-lange-serie-at1000
Il titolatore automatizza il metodo Ripper Schmitt
I reattivi di reazione vendono dosati attraverso alle pompe peristaltiche.
Pompa 1 H2SO4 Acido Solforico
Pompa 2 NaOH Sodio Idrato
Lo iodio viene dosato automaticamente attraverso la siringa da 10.000ml controllata da un motore da 24.000 step
La titolazione avviene in modo completamente automatico grazie ad un elettrodo Platino-Platino a cui è
applicata una micro corrente di polarizzazione











